
Sodyum hidroksit, asit mi yoksa baz mıdır?
Sodyum hidroksit, güçlü bir baz olarak bilinen ve birçok endüstriyel alanda geniş bir kullanım yelpazesine sahip bir kimyasaldır. Bu makalede, sodyum hidroksitin kimyasal özellikleri, asit-baz teorilerine göre sınıflandırılması ve çeşitli uygulama alanları ele alınmaktadır.
Sodyum Hidroksit: Asit mi Yoksa Baz mıdır?Sodyum hidroksit (NaOH), genellikle kostik soda olarak bilinen ve birçok endüstriyel uygulamada yaygın olarak kullanılan bir kimyasaldır. Bu makalede, sodyum hidroksitin kimyasal özellikleri, asit-baz karakteristikleri ve uygulamaları üzerinde durulacaktır. Sodyum Hidroksitin Kimyasal Yapısı Sodyum hidroksit, sodyum (Na) ve hidroksit iyonu (OH⁻) içeren bir tuzdur. Kimyasal formülü NaOH olan bu bileşik, suda çözündüğünde güçlü bir alkalin (bazik) çözeltisi oluşturur. Sodyum hidroksit, suda tamamen iyonlaşarak Na⁺ ve OH⁻ iyonlarına ayrılır. Bu özellik, sodyum hidroksitin güçlü bir baz olduğunu göstermektedir. Asit-Baz Teorileri Asit-baz kimyası, farklı teorilere dayanarak tanımlanabilir. En yaygın teoriler şunlardır:
Bu teoriler çerçevesinde sodyum hidroksitin bazik özelliği daha iyi anlaşılabilir. Arrhenius Teorisi Arrhenius teorisine göre, bir asit suya çözüldüğünde H⁺ iyonu, bir baz ise OH⁻ iyonu üretir. Sodyum hidroksit, suda çözündüğünde OH⁻ iyonları ürettiği için bu teoriye göre bir bazdır. Brønsted-Lowry Teorisi Brønsted-Lowry teorisi, asitleri proton (H⁺) veren, bazları ise proton kabul eden maddeler olarak tanımlar. Sodyum hidroksit, proton kabul etme yeteneği ile bir baz olarak işlev görür. Lewis Teorisi Lewis teorisi, asitleri elektron çeken, bazları ise elektron donörleri olarak tanımlar. Sodyum hidroksit, elektron vererek bazik özellik gösterdiği için bu tanıma uymaktadır. Sodyum Hidroksitin Özellikleri Sodyum hidroksit, fiziksel ve kimyasal özellikleri bakımından aşağıdaki gibi tanımlanabilir:
Sodyum Hidroksitin Kullanım Alanları Sodyum hidroksit, birçok endüstriyel ve laboratuvar uygulamalarında kullanılan önemli bir bileşiktir. Kullanım alanları şunlardır:
Sonuç Sodyum hidroksit, güçlü bir bazdır ve birçok asit-baz teorisi açısından bu tanımını destekleyen özelliklere sahiptir. Endüstriyel uygulamalardaki yaygın kullanımı, onun kimyasal ve fiziksel özelliklerinin önemini vurgulamaktadır. Sodyum hidroksit, asitlerle etkileşime geçtiğinde nötralizasyon reaksiyonları gerçekleştirdiği için, kimyasal denge sağlanmasına yardımcı olur. Bu nedenle, sodyum hidroksit, hem akademik hem de pratik alanlarda önemli bir bileşiktir. Ekstra Bilgiler Sodyum hidroksit, sağlık ve güvenlik açısından dikkatli bir şekilde kullanılmalıdır. Deriyle teması ciltte yanıklara yol açabileceğinden, koruyucu ekipman kullanılması gerekmektedir. Ayrıca, sodyum hidroksit çözeltileri, uygun bir şekilde depolanmalı ve atılmalıdır. Bu bilgiler ışığında, sodyum hidroksitin kimyasal özellikleri ve uygulamaları, onun bazik doğasını ve pratikteki önemini göstermektedir. |




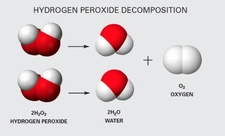
.webp)


































Sodyum hidroksitin güçlü bir baz olduğunu öğrenmek ilginç. Bu kadar yaygın bir kimyasalın, özellikle temizlik ürünlerinde ve su arıtma süreçlerinde kullanılması gerçekten dikkat çekici. Sodyum hidroksitin farklı asit-baz teorileri çerçevesinde nasıl tanımlandığını anlamak, kimyasal etkileşimleri daha iyi kavramamı sağladı. Özellikle Arrhenius teorisine göre OH- iyonu üreterek bazik özellik göstermesi, bu bileşiğin ne kadar önemli olduğunu gösteriyor. Peki, sodyum hidroksitin ciltle teması durumunda alınması gereken önlemler hakkında daha fazla bilgi verir misin?
Sodyum Hidroksit ve Cilt Teması
Abdülaziz, sodyum hidroksit, güçlü bir baz olarak ciltle temas ettiğinde ciddi yanıklara neden olabilecek bir madde olduğu için dikkatli olunması gereken bir kimyasaldır. Ciltle teması durumunda alınması gereken önlemler şunlardır:
1. Temas Durumunda Hızlı Müdahale
Ciltle temas halinde hemen bol su ile durulama yapılmalıdır. Bu, kimyasalın ciltte daha fazla zarar vermesini önleyecektir. En az 15 dakika boyunca su ile durulamak önerilir.
2. Koruyucu Ekipman Kullanımı
Sodyum hidroksit ile çalışırken eldiven, koruyucu gözlük ve uygun yüz koruyucu ekipman kullanmak son derece önemlidir. Bu, kimyasalın cilt veya gözle temasını engeller.
3. Temizlik ve Dezenfeksiyon
Temas sonrası ciltte herhangi bir kimyasal kalıntı kalmaması için hemen sabun ve su ile yıkanmalı ve ardından kuru bir havluyla iyice kurulanmalıdır.
4. Tıbbi Yardım Almak
Eğer ciltte yanık veya tahriş oluşursa derhal bir sağlık kuruluşuna başvurmak gerekir. Bu tür durumlarda profesyonel müdahale önemlidir.
Bu önlemler, sodyum hidroksit ile güvenli bir şekilde çalışabilmeniz için kritik öneme sahiptir. Kimyasal maddelerle çalışırken her zaman dikkatli olmak ve güvenlik önlemlerini ihmal etmemek gerekmektedir.