
Sodyum Oksit Özellikleri ve Faydaları Nelerdir?
Sodyum oksit (Na2O), sodyum ve oksijenin birleşiminden oluşan önemli bir kimyasal bileşiktir. Beyaz veya açık sarı toz formunda bulunan bu madde, endüstride cam ve seramik üretiminde kritik bir rol oynamaktadır. Ayrıca, fizyolojik faydaları ve çevresel etkileri ile dikkat çekmektedir.
Sodyum oksit (Na2O), sodyum ve oksijenin birleşiminden oluşan bir kimyasal bileşiktir. Genellikle beyaz veya açık sarı bir toz şeklinde bulunur ve çeşitli endüstriyel uygulamalarda önemli bir rol oynar. Sodyum oksit, sodyumun oksijenle tepkimesi sonucu elde edilir ve doğada serbest halde bulunmaz. Bu makalede, sodyum oksidin temel özellikleri ve faydaları üzerinde durulacaktır. 1. Kimyasal Özellikleri Sodyum oksidin kimyasal özellikleri, onun endüstriyel uygulamalarını belirler. Aşağıda bu bileşiğin bazı temel kimyasal özellikleri sıralanmıştır:
Sodyum oksit, su ile tepkimeye girdiğinde sodyum hidroksit (NaOH) oluşturur. Bu özellik, onu alkali bir bileşik olarak sınıflandırır. Aynı zamanda, asidik bileşenlerle de etkileşime girerek tuzlar meydana getirebilir. 2. Fizyolojik Faydaları Sodyum oksidin bazı fizyolojik faydaları bulunmaktadır. Bunlar arasında:
Ancak, sodyum oksidin aşırı tüketimi veya yanlış kullanımı sağlık sorunlarına yol açabilir. Bu nedenle, sodyum oksit kullanırken dikkatli olunması önemlidir. 3. Endüstriyel Uygulamaları Sodyum oksit, çeşitli endüstriyel süreçlerde kullanılır. Bu uygulamalar şunlardır:
Sodyum oksit, cam üretiminde özellikle önemli bir bileşiktir. Camın sıcaklık dayanımını artırmak ve opaklığını azaltmak için kullanılır. 4. Çevresel Etkileri Sodyum oksidin çevresel etkileri de dikkate alınmalıdır. Aşağıda bu etkiler sıralanmıştır:
Bu nedenle, sodyum oksit kullanımı sırasında çevresel etkilerin minimize edilmesi için gerekli önlemler alınmalıdır. Sonuç Sodyum oksit, hem kimyasal özellikleri hem de endüstriyel uygulamalarıyla önemli bir bileşiktir. Fizyolojik faydalarıyla vücut işlevlerine katkıda bulunurken, endüstride cam, seramik ve diğer kimyasal ürünlerin üretiminde kritik bir rol oynamaktadır. Ancak, çevresel etkileri ve sağlık riskleri göz önünde bulundurularak dikkatli bir şekilde kullanılmalıdır. Sodyum oksidin yararları ve zararları, bu bileşiğin kullanımı sırasında dengelenmelidir. |




.webp)


































Sodyum oksit (Na2O) hakkında bilgiye sahip olmak, özellikle endüstriyel uygulamaları ve fizyolojik etkileri açısından önemlidir. Na2O Lewis yapısı ile ilgili detaylar, bileşiğin reaktivitesini anlamak için kritik. Peki, Na2O'nun Lewis yapısını incelerken hangi özelliklere dikkat etmeliyiz?
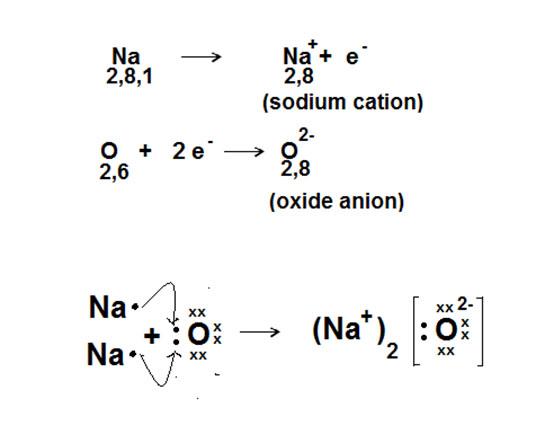
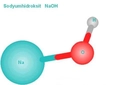
Sodyum Oksit (Na2O) ve Lewis Yapısı
Na2O, sodyum ve oksijen atomlarının bir bileşiğidir ve iyonik bir yapıya sahiptir. Lewis yapısını incelerken dikkate almanız gereken bazı önemli özellikler vardır:
Elektron Dağılımı
Na2O, sodyum atomlarının (+1) yüklü iyonlar olarak, oksijen atomunun ise (-2) yüklü iyon olarak birleşmesiyle oluşur. Bu yapının anlaşılması, molekülün kimyasal reaktivitesini etkileyen temel bir faktördür.
Bağların Doğası
Na2O'daki bağlar iyonik olduğundan, sodyum ve oksijen arasındaki etkileşimlerin gücü, bileşiğin özelliklerini belirler. İyonik bağların kuvveti, bileşiğin erime ve kaynama noktalarını etkiler.
Yükseklik ve Geometri
Lewis yapısında, sodyum iyonları ve oksijen iyonu arasındaki düzen, bileşiğin üç boyutlu yapısını anlamak açısından önemlidir. Oksijenin çevresindeki elektron çiftleri, molekülün şeklinin belirlenmesinde rol oynar.
Reaktivite
Na2O'nun reaktivitesi, Lewis yapısının analizi ile daha iyi anlaşılabilir. Örneğin, su ile etkileşimi sonucunda sodyum hidroksit (NaOH) oluşturması, bileşiğin kimyasal davranışını gösterir.
Fizyolojik Etkiler
Na2O'nun insan vücudu üzerindeki etkileri de göz önünde bulundurulmalıdır. Aşırı miktarda alımı, sağlık sorunlarına yol açabilir. Bu nedenle, sodyum oksidin endüstriyel uygulamalarındaki güvenlik önlemleri de önemlidir.
Na2O'nun Lewis yapısını incelerken bu özelliklere dikkat etmek, bileşiğin kimyasal ve fiziksel özelliklerini anlamak açısından kritik bir rol oynar.
Sodyum oksit formülü Na2O olan bu bileşik, birçok endüstride önemli roller üstleniyor. Özellikle cam ve seramik üretiminde sağladığı kalite artışı dikkat çekici. Sodyum oksit formülü ile daha verimli kimyasal tepkimeler gerçekleştirmek mümkün mü? Bu konuda daha fazla bilgiye ulaşabilir miyim?
Sodyum Oksit ve Kimyasal Tepkimeler
Bejan, sodyum oksit (Na2O) gerçekten de birçok endüstride önemli bir bileşiktir. Cam ve seramik üretiminde, Na2O'nun kullanımı camın akışkanlığını artırarak daha düşük sıcaklıklarda işlenmesini sağlar. Bu, enerji tasarrufu açısından oldukça avantajlıdır.
Daha Verimli Kimyasal Tepkimeler
Sodyum oksit, özellikle alkali metal oksitleri arasında yer aldığı için, asitlerle tepkimeye girerek tuz ve su oluşturur. Bu özellik, Na2O'yu birçok kimyasal tepkimede reaktör olarak kullanmaya uygun hale getirir. Özellikle cam ve seramik üretiminde, silikatların çözünürlüğünü artırarak daha az enerji ile daha verimli tepkimeler gerçekleştirilmesine olanak tanır.
Bilgi Kaynakları
Daha fazla bilgiye ulaşmak için, kimya alanında güvenilir kitaplar, akademik makaleler ve endüstriyel raporlar inceleyebilirsiniz. Ayrıca, üniversitelerin kimya bölümleri veya malzeme bilimi üzerine yapılan araştırmalar da faydalı olabilir. Online kaynaklar ve bilimsel dergiler de güncel gelişmeler hakkında bilgi edinmenizi sağlayabilir.
Sodyum elementinin suyla ani tepkimeye girdiğini ve yanıcı hidrojen gazı oluşturduğunu öğrendim, bu tepkimeyi görsem tehlikeli olur mu?
Merhaba Muttalib,
Sodyum elementinin suyla tepkimeye girmesi gerçekten de çok hızlı ve yoğun bir enerji açığa çıkardığından tehlikeli olabilir. Bu tepkime sonucunda yanıcı hidrojen gazı oluşur ve bu da patlamalara veya yangınlara neden olabilir. Bu nedenle, bu tür bir deneyi kesinlikle uygun laboratuvar koşullarında ve gerekli güvenlik önlemleri alınmış olarak gerçekleştirmek gerekir. Güvenlik ekipmanları ve uzman denetimi olmadan bu tür bir tepkimeyi gözlemlemek veya denemek çok risklidir.
Sağlıklı ve güvenli çalışmalar dilerim.