
Sodyum Peroksit Nedir?
Sodyum peroksit, güçlü bir oksitleyici madde olarak endüstriyel ve laboratuvar uygulamalarında önemli bir yer tutar. Temizlik, su arıtma ve tekstil gibi alanlarda kullanımı yaygındır. Ancak, güvenli bir şekilde kullanılması için belirli önlemler almak gereklidir.
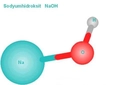
Sodyum peroksit (Na2O2), sodyum ve oksijen elementlerinin bir bileşiğidir. Genellikle beyaz veya sarımsı bir toz halinde bulunur ve güçlü bir oksitleyici madde olarak bilinir. Sodyum peroksit, çeşitli endüstriyel ve laboratuvar uygulamalarında kullanılmaktadır. Bu bileşik, özellikle su arıtma, tekstil, kağıt ve gıda endüstrisi gibi alanlarda önemli bir rol oynamaktadır. Sodyum Peroksitin Özellikleri Sodyum peroksit, fiziksel ve kimyasal özellikleri ile dikkat çekmektedir. Bu özellikler şunlardır:
Sodyum Peroksitin Kullanım Alanları Sodyum peroksit, birçok farklı alanda kullanılmaktadır. Bu kullanım alanları arasında şunlar yer almaktadır:
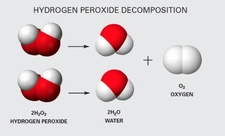
Sodyum Peroksitin Kimyasal Tepkimesi Sodyum peroksit, su ile tepkimeye girdiğinde, çeşitli ürünler oluşturur. Bu tepkime, aşağıdaki şekilde gösterilebilir: Na2O2 + 2 H2O → 2 NaOH + H2O2Bu tepkime, sodyum hidroksit ve hidrojen peroksit üretir. Bu nedenle, sodyum peroksit, su arıtma süreçlerinde hem dezenfektan hem de pH düzenleyici olarak kullanılabilir. Sodyum Peroksitin Güvenlik ve Saklama Koşulları Sodyum peroksit, güçlü bir oksitleyici madde olduğundan, dikkatli bir şekilde kullanılmalıdır. Aşağıda, sodyum peroksitin güvenli kullanımına dair bazı ipuçları verilmiştir:
Sonuç Sodyum peroksit, güçlü bir oksitleyici madde olarak birçok endüstriyel ve laboratuvar uygulamasında önemli bir rol oynamaktadır. Kullanım alanları, temizlikten su arıtımına kadar geniş bir yelpazeyi kapsamaktadır. Güvenli bir şekilde kullanılması, potansiyel tehlikelerin önlenmesi açısından son derece önemlidir. Bu bağlamda, sodyum peroksitin özellikleri, kullanımı ve güvenlik önlemleri hakkında bilgi sahibi olmak, bu bileşiği kullanacak olanlar için kritik öneme sahiptir. Bu makale, sodyum peroksit hakkında genel bir bakış sağlamayı amaçlamakta olup, daha fazla bilgi ve detay için uzman kaynaklardan yararlanılması önerilmektedir. |





.webp)


































Sodyum peroksit hakkında bu kadar detaylı bilgiye sahip olmak gerçekten etkileyici. Özellikle kullanım alanları ve kimyasal özellikleri üzerine yapılan açıklamalar oldukça bilgilendirici. Deterjanlar ve sağlık ürünlerinde dezenfektan olarak kullanılması, bu bileşiğin ne kadar önemli bir rol oynadığını gösteriyor. Ayrıca, sodyumun doğadaki bulunumu ve bileşikleri hakkında verdiğiniz bilgiler, kimya ile ilgilenenler için oldukça faydalı. Peki, sodyum peroksitin çevresel etkileri veya güvenlik önlemleri hakkında daha fazla bilgi verebilir misiniz?
Merhaba Toğay,
Yorumunuz için teşekkür ederim. Sodyum peroksit gerçekten de çeşitli alanlarda önemli bir bileşen.
Çevresel Etkileri: Sodyum peroksit, su ve oksijene ayrışabilen bir bileşiktir, bu da onu çevre için daha az zararlı hale getirir. Ancak yüksek konsantrasyonlarda kullanıldığında su ekosistemlerine zarar verebilir. Bu nedenle, sodyum peroksit içeren ürünlerin doğaya atılmaması ve uygun şekilde bertaraf edilmesi önemlidir.
Güvenlik Önlemleri: Sodyum peroksit kullanırken dikkat edilmesi gereken bazı güvenlik önlemleri bulunmaktadır. Cilt ve göz ile temastan kaçınılmalı, kullanırken eldiven ve koruyucu gözlük takılması önerilir. Ayrıca, iyi havalandırılan bir alanda kullanılmalı ve soluma yoluyla maruz kalmaktan kaçınılmalıdır.
Bu bilgilerin sodyum peroksit hakkında daha kapsamlı bir anlayış sunmasına yardımcı olacağını umuyorum. Başka sorularınız varsa, memnuniyetle yanıtlarım.