
Sodyum Simgesi Türleri ve Özellikleri
Sodyum, kimyasal ve biyolojik süreçlerde önemli bir rol oynayan, alkali metaller grubunda yer alan bir elementtir. Bu makalede sodyumun özellikleri, simgeleri ve sağlık üzerindeki etkileri ele alınmaktadır. Sodyumun doğru dengesi, sağlıklı bir yaşam için kritik öneme sahiptir.
Sodyum Simgesi Türleri ve Özellikleri Sodyum, periyodik cetvelde Na sembolü ile gösterilen bir elementtir. Alkali metaller grubunda yer alan bu element, doğada yaygın olarak bulunan ve birçok biyolojik ve kimyasal süreçte kritik bir rol oynayan bir elementtir. Bu makalede, sodyum simgesi türleri ve özellikleri üzerinde durulacaktır. Sodyum Elementinin Genel Özellikleri Sodyumun özellikleri, onun kimyasal ve fiziksel niteliklerini anlamak için önemlidir. Aşağıda sodyumun temel özellikleri listelenmiştir:
Sodyum, gümüşi beyaz renkte, yumuşak bir metaldir. Hava ile temas ettiğinde hızla oksitlenir ve bu nedenle genellikle mineral yağlarda saklanır. Sodyum, su ile şiddetli bir reaksiyon gösterir ve bu durum, onun alkali metaller grubundaki yerini vurgular. Sodyum Simgesi ve Kimyasal Reaksiyonları Sodyum, genellikle çeşitli bileşiklerde bulunur ve bu bileşikler, endüstriyel ve biyolojik sistemlerde önemli işlevler üstlenir. Aşağıda sodyumun bazı yaygın bileşikleri verilmiştir:
Sodyumun kimyasal reaksiyonları, genellikle reaktif doğası nedeniyle oldukça dikkat çekicidir. Özellikle su ile yaptığı reaksiyon, hidrojen gazı ve sodyum hidroksit üretir. Bu reaksiyon, ısı açığa çıkararak patlayıcı bir nitelik kazanabilir. Sodyumun Biyolojik Önemi Sodyum, vücut için önemli bir mineral olup, birçok biyolojik süreçte rol oynar. Bu süreçler arasında:
Yetersiz sodyum alımı, düşük tansiyona ve kas kramplarına neden olabilir. Öte yandan, aşırı sodyum alımı ise hipertansiyona ve kardiyovasküler hastalıklara yol açabilir. Sodyum Simgesi Türleri Sodyumun farklı simgeleri arasında çeşitli biçimler yer alır. Bunlar genellikle bilimsel ve endüstriyel uygulamalarda kullanılır:
Sodyum, hem kimyasal formül hem de iyonik form olarak çeşitli durumlarda temsil edilir. Özellikle Na⁺ iyonu, biyolojik sistemlerde önemli bir rol oynar. Sonuç Sodyum, hem kimyasal hem de biyolojik açıdan kritik bir elementtir. Farklı simgeleri ve bileşikleri, onun çok yönlü kullanım alanlarını gösterirken, sağlığımız üzerindeki etkileri de dikkat çekicidir. Bu nedenle, sodyumun alımı ve dengesi, sağlıklı bir yaşam sürdürmek için önem arz etmektedir. Ek olarak, sodyum ile ilgili daha fazla bilgi ve araştırma, onun çeşitli uygulamalarını ve sağlık üzerindeki etkilerini daha iyi anlamamıza yardımcı olacaktır. |





.webp)


































Sodyum sembolü Na, birçok biyolojik ve kimyasal süreçte kritik bir rol oynamaktadır. Özellikle sinir iletimi ve su dengesi için gerekli olan bu elementin, aşırı veya yetersiz alımı sağlık sorunlarına yol açabilir. Sodyumun önemi ve işlevleri hakkında daha fazla bilgi edinmek faydalı olacaktır.
Cevhere,
Sodyumun Önemi
Sodyum, vücudumuzda birçok önemli işlevi yerine getiren bir elementtir. Özellikle hücrelerin normal işleyişi için gereklidir. Sinir hücreleri arasındaki iletişimi sağlarken, kas kasılmaları ve kalp atışı gibi hayati süreçlerde de rol oynar.
Sodyum ve Su Dengesi
Sodyum, vücuttaki su dengesini sağlamada kritik bir bileşendir. Böbrekler, sodyum seviyelerini düzenleyerek sıvı dengesini kontrol eder. Yetersiz veya aşırı sodyum alımı, vücudun su dengesini bozarak çeşitli sağlık sorunlarına yol açabilir.
Aşırı veya Yetersiz Alımın Sonuçları
Aşırı sodyum alımı, hipertansiyon (yüksek tansiyon) gibi kalp ve damar hastalıklarına neden olabilirken, yetersiz alım ise kas krampları, baş dönmesi ve diğer ciddi sağlık sorunlarına yol açabilir. Bu nedenle, günlük sodyum alımını dengede tutmak son derece önemlidir.
Sodyumun biyolojik ve kimyasal süreçlerdeki rolü hakkında daha fazla bilgi edinmek, sağlıklı bir yaşam sürdürmek açısından faydalı olacaktır.
Sodyumun kimyasal özellikleri oldukça ilginç. Özellikle cıvanın simgesi gibi, sodyumun Na sembolü ile gösterilmesi, onun ne kadar yaygın ve önemli bir element olduğunu vurguluyor. Peki, sodyumun reaktif doğası ve su ile yaptığı reaksiyonlar hakkında daha fazla bilgi verebilir misin?
Sodyumun Reaktif Doğası
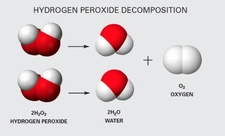
Sodyum, alkali metaller grubunda yer alan oldukça reaktif bir elementtir. Hava ile temas ettiğinde hızla oksitlenir ve bu nedenle genellikle mineral yağ içerisinde saklanır. Sodyum, su ile karşılaştığında oldukça şiddetli bir reaksiyon gösterir. Bu reaksiyon sırasında sodyum, su ile birleşerek sodyum hidroksit ve hidrojen gazı üretir. Bu süreç oldukça egzotermiktir, yani ısı açığa çıkar ve bazı durumlarda patlamalara bile yol açabilir.
Su ile Reaksiyon
Sodyumun su ile tepkimesi şu şekilde gerçekleşir:
2 Na + 2 H2O → 2 NaOH + H2
Bu reaksiyonda sodyum hidroksit (NaOH) çözeltisi oluşurken, hidrojen gazı da serbest kalır. Oluşan hidrojen gazı, su yüzeyinde baloncuklar şeklinde görünür ve bu durum sodyumun ne kadar reaktif olduğunu gösterir.
Güvenlik ve Kullanım
Bu nedenle, sodyum ile su arasındaki etkileşim oldukça dikkatli bir şekilde ele alınmalıdır. Sodyum, birçok endüstriyel uygulamada kullanılır, örneğin, sodyum hidroksit, temizlik maddeleri ve kimyasal üretiminde yaygın olarak kullanılır. Ancak, sodyumun reaktif doğası nedeniyle, bu elementin kullanımı sırasında güvenlik önlemlerinin alınması son derece önemlidir.
Sodyumun simgesi Na olarak biliniyor. Bu elementin özellikleri ve kullanımları hakkında daha fazla bilgi edinmek için araştırma yapmayı düşünüyorum. Sodyum, sanırım birçok endüstriyel uygulamada kritik bir rol oynuyor. Peki, sodyumun simgesi hakkında ne düşünüyorsunuz?
Sodyumun Simgesi Na
Sodyumun simgesi "Na", Latince "Natrium" kelimesinden türetilmiştir. Bu durum, elementin tarihi ve kökeni hakkında ilginç bir bilgi sunar. Na sembolü, kimyasal elementlerin evrensel sisteminde standart bir göstergedir ve bu da sodyumun tanınabilirliğini artırır.
Sodyumun Özellikleri
Sodyum, alkali metaller grubunda yer alır ve reaktif bir elementtir. Özellikle su ile tepkimeye girdiğinde çok fazla enerji açığa çıkarır. Bu özellikleri nedeniyle, sodyumun depolanması dikkat gerektirir. Ayrıca, sodyum metalik bir görünüşe sahiptir ve yumuşak bir yapıya sahiptir, bu da onu kolayca şekillendirilebilir hale getirir.
Kullanım Alanları
Sodyum, birçok endüstriyel uygulamada kritik bir rol oynamaktadır. Örneğin, cam üretiminde, sabun yapımında ve kimyasal sentezlerde yaygın olarak kullanılır. Bunun yanı sıra, gıda endüstrisinde de önemli bir yer tutarak, gıdaların korunmasında ve lezzet artırmada kullanılır. Sodyum klorür (sofra tuzu) olarak günlük yaşamda da sıkça karşılaştığımız bir bileşiktir.
Sonuç olarak, sodyumun simgesi ve özellikleri, bu elementin çeşitli alanlardaki önemini ve işlevselliğini gözler önüne seriyor. Araştırma yapmayı düşünmemenize rağmen, bu basit bilgiler bile sodyumun ne kadar önemli bir element olduğunu göstermektedir.
Sodyumun doğada serbest halde bulunmaması ilginç bir durum değil mi? Hangi bileşenlerle en çok reaksiyona girdiğini merak ettim. Özellikle su ile hızlı bir şekilde reaksiyona girmesi ve hidrojen gazı açığa çıkarması, sodyumun reaktif doğasını gösteriyor. Ayrıca, elektroliz yöntemiyle elde edilmesi de oldukça etkileyici. Sodyumun endüstriyel alanda geniş bir kullanım yelpazesine sahip olması, bu metalin önemini artırıyor. Sizce sodyumun bu kadar reaktif olmasının, endüstriyel uygulamalarda sağladığı faydalar neler olabilir?
Reaktif Doğa ve Sodyum
Sabahaddin, sodyumun doğada serbest halde bulunmaması gerçekten de ilginç bir durum. Bu durum, sodyumun yüksek reaktivitesinden kaynaklanıyor. Sodyum, genellikle klor ve oksijen gibi elementlerle bileşikler oluşturmak üzere hızlı bir şekilde reaksiyona girer. Özellikle su ile tepkimeye girmesi, onu oldukça dikkat çekici kılıyor; çünkü bu tepkime sırasında hidrojen gazı açığa çıkar ve bu da sodyumun reaktif doğasını net bir şekilde ortaya koyuyor.
Elektroliz Yöntemi ve Endüstriyel Kullanımlar
Elektroliz yöntemiyle elde edilmesi, sodyumun endüstriyel alanda ne kadar önemli olduğunu gösteriyor. Sodyum, metalik yapısı sayesinde birçok endüstriyel uygulamada kullanılıyor. Örneğin, kimya sanayinde, sodyum karbonat ve sodyum klorür gibi bileşenlerin üretiminde önemli bir rol oynuyor. Ayrıca, sodyumun reaktif özelliği, onu metalik bileşiklerin sentezinde ve bazı metal alaşımlarında katalizör olarak kullanmak için ideal kılıyor.
Faydaları
Sodyumun bu kadar reaktif olması, özellikle enerji üretimi ve depolama alanında da faydalar sağlıyor. Örneğin, sodyum sülfür pilleri, yüksek enerji yoğunluğu ve uzun ömürleri ile dikkat çekiyor. Ayrıca, sodyumun düşük maliyeti ve bol bulunabilirliği, onu alternatif enerji kaynakları üzerinde çalışmalarda cazip bir seçenek haline getiriyor. Sonuç olarak, sodyumun reaktif doğası, endüstriyel uygulamalarda birçok fayda sağlarken, aynı zamanda dikkatli bir şekilde kullanılmasını gerektiriyor.