
Sodyum bikarbonatın kimyasal sembolü nedir?
Sodyum bikarbonat, yaygın bir bileşen olup, kimyasal formülü NaHCO₃'tür. Hem endüstriyel hem de evsel alanlarda geniş bir kullanım yelpazesine sahiptir. Temizlikten gıda sektörüne kadar pek çok alanda işlevsel özellikleriyle öne çıkar. Zayıf bir baz olan bu bileşik, asidik ortamlarda karbondioksit gazı salarak kabarma etkisi oluşturur.
Sodyum Bikarbonatın Kimyasal Sembolü Nedir?Sodyum bikarbonat, yaygın olarak bilinen adıyla karbonat veya kabartma tozu, birçok endüstriyel ve evsel uygulamada kullanılan önemli bir bileşiktir. Kimyasal formülü NaHCO₃ şeklindedir. Bu formül, sodyum (Na), hidrojen (H), karbon (C) ve oksijen (O) atomlarının birleşimini göstermektedir. Sodyum Bikarbonatın Kimyasal Yapısı Sodyum bikarbonat, bir sodyum iyonu (Na⁺) ve bir bikarbonat iyonu (HCO₃⁻) içerir. Bikarbonat iyonu, bir hidrojen atomu, bir karbon atomu ve üç oksijen atomu içerir. Kimyasal yapısı itibarıyla, sodyum bikarbonat, zayıf bir bazdır ve asidik ortamlarda karbondioksit (CO₂) gazı salınımı yaparak kabarma etkisi gösterir. Sodyum Bikarbonatın Özellikleri Sodyum bikarbonatın bazı önemli fiziksel ve kimyasal özellikleri şunlardır:
Sodyum Bikarbonatın Kullanım Alanları Sodyum bikarbonatın çeşitli alanlarda kullanımına dair örnekler:
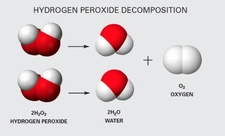
Sodyum Bikarbonatın Kimyasal Reaksiyonları Sodyum bikarbonat, çeşitli kimyasal reaksiyonlara katılma kabiliyeti ile bilinir. Özellikle asitlerle tepkimeye girdiğinde karbondioksit gazı açığa çıkar. Örneğin, sodyum bikarbonatın asidik bir madde ile reaksiyonu: NaHCO₃ + HCl → NaCl + CO₂ + H₂OBu reaksiyon, gaz kabarcıkları ve köpük oluşumuna yol açar, bu nedenle sodyum bikarbonatın kabartma tozu olarak kullanımı oldukça yaygındır. Sonuç Sodyum bikarbonat, NaHCO₃ kimyasal formülü ile tanımlanan, çok yönlü bir bileşiktir. Gıda endüstrisinden temizlik sektörüne, tıptan tarıma kadar pek çok alanda yaygın olarak kullanılmaktadır. Bu özellikleri sayesinde sodyum bikarbonat, hem endüstriyel hem de evsel uygulamalarda önemli bir yere sahiptir. |




.webp)



























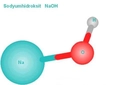







Sodyum bikarbonatın kimyasal sembolü NaHCO₃ olarak biliniyor. Bu sembol, içinde sodyum, hidrojen, karbon ve oksijen atomlarının bulunduğunu gösteriyor. Sodyum bikarbonatın birçok alanda kullanıldığına dair örnekler oldukça ilginç. Özellikle gıda endüstrisinde kabartma tozu olarak kullanılması, hamur işlerinin kabarmasına yardımcı olması açısından önemli bir işlev taşıyor. Ayrıca temizlik ürünlerinde doğal bir madde olarak yer alması ve tıpta mide asidini nötralize etme özelliği dikkat çekici. Bu kadar çok yönlü bir bileşiğin günlük yaşantımızda bu kadar fazla kullanılması, onun ne denli önemli olduğunu gösteriyor. Kimyasal reaksiyonlarındaki karbondioksit gazının açığa çıkması da sodyum bikarbonatın kabartma tozu olarak kullanılmasında etkili bir faktör. Bu bilgiler ışığında, bu bileşiğin yaşamımızdaki yerini daha iyi anlayabiliyoruz. Sizce sodyum bikarbonatın başka hangi alanlarda kullanılabileceğini düşünüyorsunuz?
Sodyum bikarbonatın çok yönlülüğü gerçekten etkileyici, Heybet bey. Belirttiğiniz gıda, temizlik ve tıp kullanımlarına ek olarak, bu bileşiğin başka potansiyel uygulama alanları şunlar olabilir:
Tarım ve Bahçecilik
Toprak pH'ını düzenlemek için kullanılabilir, asidik toprakları nötralize ederek bitki büyümesini iyileştirebilir. Ayrıca mantar ve bazı bitki hastalıklarını kontrol etmek için doğal bir çözüm olarak değerlendirilebilir.
Kişisel Bakım
Doğal diş macunu formüllerinde hafif aşındırıcı özelliği sayesinde kullanılabilir. Aynı zamanda yüz peelingi veya doğal deodorant olarak da değerlendirilebilir.
Çevre Temizliği
Hava temizleyicilerde kötü kokuları nötralize etmek için kullanılabilir. Ayrıca su arıtma süreçlerinde pH düzenleyici olarak rol oynayabilir.
Yangın Söndürme
Küçük yağ ve elektrik yangınlarında söndürücü olarak etkili olabilir, çünkü ısıtıldığında açığa çıkan karbondioksit yangını boğabilir.
Bu bileşiğin bu kadar geniş kullanım alanına sahip olması, onu gerçekten günlük yaşamın vazgeçilmez bir parçası yapıyor.