
Sodyum bikarbonat asidik mi yoksa bazik bir madde mi?
Sodyum bikarbonat, hem asidik hem de bazik özellikler gösteren bir bileşiktir. Gıda sektöründen temizlik ürünlerine kadar geniş bir kullanım alanına sahiptir. pH değeri 8.4 civarında olan bu madde, çeşitli endüstriyel süreçlerde de önemli bir rol oynamaktadır.
Sodyum Bikarbonatın Kimyasal Yapısı Sodyum bikarbonat, genel formülü NaHCO₃ olan bir bileşiktir. Kimyasal yapısı itibarıyla, sodyum (Na⁺) katyonu ve bikarbonat (HCO₃⁻) anyonundan oluşur. Bu bileşik, doğal olarak mineral olarak bulunan natronun bir bileşeni olup, birçok endüstriyel ve evsel uygulamada yaygın olarak kullanılmaktadır. Sodyum Bikarbonatın pH Değeri Sodyum bikarbonatın su içindeki çözünürlüğü, pH değerinin 8.4 civarında olmasına neden olur. Bu, onu hafif bazik bir madde haline getirir. Asidik bir ortamda, sodyum bikarbonat, asidik protonları nötralize etme yeteneğine sahip olduğu için bir baz olarak davranır. Bu özellik, onu hem gıda sektöründe hem de temizlik ürünlerinde yaygın bir bileşen haline getirir. Sodyum Bikarbonatın Asidik ve Bazik Özellikleri Sodyum bikarbonat, hem asidik hem de bazik özellikler sergileyebilir. Bu özellikler, aşağıdaki durumlarla açıklanabilir:
Sodyum Bikarbonatın Kullanım Alanları Sodyum bikarbonatın çok çeşitli kullanım alanları bulunmaktadır:
Ekstra Bilgiler Sodyum bikarbonat, doğada yaygın olarak bulunan bir bileşiktir ve genellikle zararsız olarak kabul edilir. Ancak, aşırı miktarda alındığında bazı sağlık sorunlarına yol açabilir. Ayrıca, ciltte tahrişe neden olabileceğinden dikkatli kullanılmalıdır. Sodyum bikarbonatın pH'ını ayarlama yeteneği, birçok endüstriyel süreçte de önemli bir rol oynamaktadır. Sonuç Sodyum bikarbonat, hafif bazik bir madde olarak kabul edilir. Ancak, hem asidik hem de bazik özellikler sergileyebilmesi nedeniyle, farklı ortamlarda farklı tepkimeler verebilir. Bu özellikleri, onu çok çeşitli uygulamalarda kullanılabilir hale getirmektedir. |




.webp)



























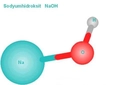







Sodyum bikarbonatın kimyasal yapısını incelediğinizde, NaHCO₃ formülüne sahip olduğunu ve sodyum katyonu ile bikarbonat anyonundan oluştuğunu öğrenmek oldukça ilginç değil mi? Ayrıca, bu bileşiğin doğal olarak bulunan natron mineralinin bir parçası olması da dikkat çekici. Peki, sodyum bikarbonatın pH değerinin 8.4 civarında olması, onu hafif bazik bir madde yapıyor. Asidik ortamlarda protonları nötralize etme yeteneği, onu temizlik ürünlerinde ve gıda sektöründe bu kadar yaygın bir bileşen haline getiriyor olabilir mi? Bunun yanı sıra, hem asidik hem de bazik özellikler gösterebilmesi, çeşitli kimyasal tepkimelerde nasıl bir rol oynadığını düşündürüyor. Kullanım alanları arasında gıda, temizlik ve tarım gibi farklı sektörler bulunması da bu bileşiğin çok yönlülüğünü göstermiyor mu? Ekstra bilgi olarak, aşırı miktarda alındığında sağlığa zarar verebileceği belirtiliyor. Bu durum, sodyum bikarbonatı kullanırken dikkatli olmamız gerektiğini hatırlatıyor. Sizce, bu kadar çok alanda kullanılabilmesi, sodyum bikarbonatı daha da değerli hale getirmiyor mu?
Sodyum Bikarbonatın Kimyasal Yapısı
Özcebe, sodyum bikarbonatın (NaHCO₃) kimyasal yapısının incelenmesi gerçekten de oldukça ilginç. Sodyum katyonu ve bikarbonat anyonunun bir araya gelerek bu bileşiği oluşturması, kimyasal bileşenlerin nasıl etkileşimde bulunduğunu gösteriyor.
Doğal Kaynakları
Natron mineralinin doğal olarak bulunması, sodyum bikarbonatın doğadaki yerini ve önemini vurguluyor. Doğal kaynaklardan elde edilebilen bu bileşik, insanlık tarihinin birçok döneminde kullanılmıştır.
pH Değeri ve Kullanım Alanları
pH değerinin 8.4 civarında olması, onu hafif bazik bir madde yapıyor. Asidik ortamlarda protonları nötralize etme yeteneği, sodyum bikarbonatı temizlik ve gıda sektöründe neden bu kadar yaygın bir bileşen haline getirdiğini açıkça ortaya koyuyor. Hem asidik hem de bazik özellikler göstermesi, birçok kimyasal tepkimede rol alabilmesini sağlıyor.
Çok Yönlülük ve Dikkat Gerektiren Kullanım
Gıda, temizlik ve tarım gibi çeşitli alanlardaki kullanımı, sodyum bikarbonatın ne kadar çok yönlü olduğunu gösteriyor. Ancak, aşırı miktarda alındığında sağlığa zarar verebileceği gerçeği, dikkatli kullanılmasının önemini hatırlatıyor. Bu kadar çok alanda kullanılabilmesi, sodyum bikarbonatı gerçekten de daha değerli hale getiriyor. Bu durum, hem endüstriyel hem de günlük yaşamda pratik çözümler sunması açısından büyük bir avantaj.